Nazewnictwo izomerów przestrzennych:
reguły Cahna, Ingolda, Preloga pierwszeństwa podstawników
1. Typy izomerii
Zjawisko izomerii polega na występowaniu różnych związków chemicznych mających takie same wzory sumaryczne, a różniących się sposobem lub kolejnością powiązania atomów, albo rozmieszczeniem atomów w przestrzeni. Izomery różniące się sposobem i kolejnością powiązania atomów nazywa się izomerami konstytucyjnymi. Na przykład eter dimetylowy, CH3-O-CH3 jest izomerem konstytucyjnym etanolu, CH3-CH2-OH. Do tego typu izomerii zalicza się izomerie: funkcyjną (np. propanon i propanal), pozycyjną (np. 1-propanol i 2-propanol) oraz szkieletową (w tym: łańcuchową, np. n-butan i izobutan oraz pierścieniową, np. metylocyklopentan i cykloheksan).
Stereoizomerami nazywane są takie izomery, które mają identyczną konstytucję (sposób i kolejność powiązania atomów), a różnią się tylko przestrzennym rozmieszczeniem atomów. Zjawisko stereoizomerii obejmuje więc izomerię geometryczną związków z wiązaniem podwójnym, izomerię geometryczną podstawionych związków pierścieniowych oraz izomerię optyczną.
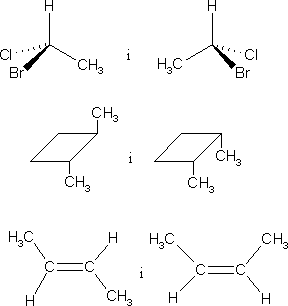
Dla określenia nazwy danego izomeru konieczne jest określenie jego konfiguracji. W klasycznym rozumieniu, konfiguracja cząsteczki o określonej konstytucji, to rozmieszczenie w przestrzeni jej atomów, bez uwzględnienia różnych położeń atomów, wynikających z obrotu fragmentów cząsteczki wokół wiązań pojedynczych. Przykłady izomerów konfiguracyjnych w takim rozumieniu:

2. Pojęcie konfiguracji
Do opisania położenia względem siebie podstawników związanych z różnymi atomami w danej cząsteczce używa się określenia konfiguracja względna. Konfiguracja absolutna opisuje przestrzenne położenie podstawników wokół chiralnego (asymetrycznego) elementu cząsteczki.
3. Izomeria geometryczna - konfiguracja względna
Tradycyjnie, dla określenia konfiguracji atomów (grup atomów) połączonych z atomami związanymi wiązaniem podwójnym lub połączonych z pierścieniem, używa się przedrostków cis i trans. O ile w prostych przypadkach stosowanie tych przedrostków nie budzi wątpliwości (w powyższym przykładzie: trans-but-2-en oraz cis-but-2-en), to w przypadkach bardziej złożonych system ten nie jest wystarczający. Dlatego zaleca się stosowanie w nazewnictwie alkenów wyłącznie systemu opartego o reguły pierwszeństwa, używającego przedrostków Z, E. Przedrostki cis, trans stosuje się nadal w nazewnictwie podstawionych pochodnych związków jednopierścieniowych. Izomeria geometryczna alkenów występuje, jeżeli z obu atomami węgla związanymi wiązaniem podwójnym są połączone dwa różne atomy lub grupy atomów. Atomy lub grupy są względem siebie w pozycji cis, jeżeli leżą po tej samej stronie płaszczyzny odniesienia. Położenie trans, to położenie po przeciwnych stronach płaszczyzny odniesienia. W tradycyjnym nazewnictwie alkenów płaszczyzna taka, to płaszczyzna przechodząca przez atomy związanie wiązaniem podwójnym, prostopadła do płaszczyzny, w której leżą te atomy i atomy bezpośrednio z nimi związane. W związkach pierścieniowych płaszczyzną odniesienia jest płaszczyzna, w której leży (lub w przybliżeniu leży) szkielet pierścienia.
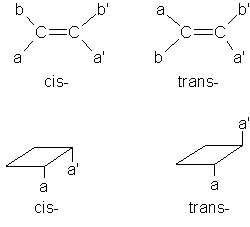
W systemie Z, E wzajemne położenie podstawników określa się na podstawie reguł pierwszeństwa opisanych niżej. Przedrostki Z i E pochodzą od niemieckich słów "zusammen" - razem i "entgegen" - przeciwnie. Na podstawie reguł pierwszeństwa ustalamy dla obu atomów węgla związanych wiązaniem podwójnym podstawniki preferowane (a i a'). Jeżeli oba te podstawniki znajdują się po tej samej stronie płaszczyzny odniesienia, stosuje się przedrostek Z, w przeciwnym razie - przedrostek E (pisane kursywą, w nawiasach). Zatem
cis-but-2-en, to (Z)-but-2-en, a trans-but-2-en to (E)-but-2-en. Przykład bardziej złożony:
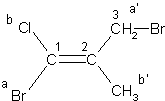
(1E)-1,3-dibromo-1-chloro-2-metyloprop-1-en
Jeżeli w cząsteczce występuje kilka wiązań podwójnych wykazujących izomerię geometryczną, dla każdego z nich określa się konfigurację i na początku nazwy umieszcza się odpowiednie oznaczenia Z lub E, z lokantami określającymi położenie odpowiednich wiązań.
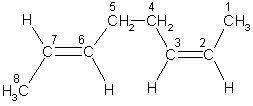
(2Z,6E)-okta-2,6-dien
(niższy lokant przypisuje się w takiej sytuacji podwójnemu wiązaniu w konfiguracji Z)
W układach pierścieniowych, w przypadku obecności różnych podstawników związanych z jednym atomem węgla, używa się dodatkowo przedrostka r, od angielskiego reference - dla określenia atomu lub grupy będącego odniesieniem dla pozycji cis lub trans innego atomu, np.:
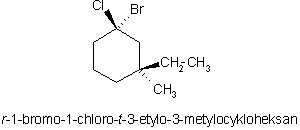
4. Izomeria optyczna - konfiguracja absolutna - reguły pierwszeństwa
Reguły pierwszeństwa podstawników stosuje się przede wszystkim przy ustalaniu nazwy systematycznej związków zawierających w cząsteczkach asymetryczne atomy węgla. Asymetryczny atom węgla, to atom połączony z czterema różnymi atomami lub grupami atomów. Obecność asymetrycznego atomu węgla w cząsteczce jest zwykle jednym z warunków wystąpienia izomerii optycznej. Aby we wzorze związku chemicznego wyrazić informację o przestrzennej budowie cząsteczki stosuje się zwykle tzw. wzory klinowe - dla jednego centrum asymetrii lub wzory rzutowe Fischera - zwykle w przypadku kilku asymetrycznych atomów węgla w cząsteczce.
Symbole wiązań we wzorach klinowych:
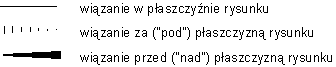
W nazwie związku informację o jego budowie przestrzennej określa się tzw. przedrostkiem stereochemicznym - (R) lub (S) - w przypadku izomerów optycznych (enancjomerów),
(Z) lub (E) - w przypadku izomerów geometrycznych.
Ustalanie nazwy systematycznej według reguł pierwszeństwa:
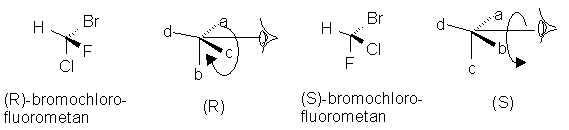
1. Podstawniki związane z asymetrycznym atomem węgla szereguje się w kolejności malejących liczb atomowych (umownie a>b>c>d), np. w CHFClBr: Br>Cl>F>H, gdzie znak ">" oznacza: "posiada pierwszeństwo w stosunku do" lub "poprzedza".
2. W celu przypisania symboli konfiguracyjnych każdemu z enancjomerów (izomerów optycznych), obserwujemy ich modele od strony przeciwnej do podstawnika zaszeregowanego jako ostatni ("d"); następnie śledzimy drogę a  b
b c i określamy kierunek - zgodny z ruchem wskazówek zegara (R, od rectus - prawy) lub przeciwny (S, od sinister - lewy). Np.
c i określamy kierunek - zgodny z ruchem wskazówek zegara (R, od rectus - prawy) lub przeciwny (S, od sinister - lewy). Np.
3. Jeżeli dwa podstawniki różnią się tylko masą atomową, to cięższy ma pierwszeństwo, np. D>H.
4. Jeżeli z centrum chiralności (izomerię optyczną nazywa się chiralnością, od greckiego cheira - dłoń) związane są dwa, trzy lub cztery identyczne atomy, to porównujemy dalsze atomy z nimi związane.
Np. a) H3C-CHCl-CH2OH
-CH3 : C(H,H,H) i -CH2OH : C(O,H,H) (w nawiasach - kolejne atomy uporządkowane wg pierwszeństwa). Ponieważ O>H, ostatecznie: Cl>CH2OH>CH3>H .
b)
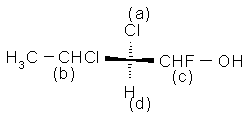 (S), bo: C(Cl, C, H) > C(F, O, H)
(S), bo: C(Cl, C, H) > C(F, O, H)
(porównujemy preferowane atomy obu grup)
c)
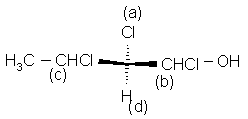 (R), bo C(Cl, O, H) > C(Cl, C, H)
(R), bo C(Cl, O, H) > C(Cl, C, H)
d)
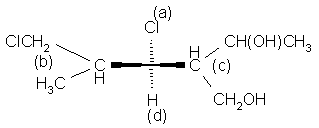
(b): C(C, C, H), gdzie C(Cl, H, H) > C(H, H, H);
(c): C(C, C, H), gdzie C(O, C, H) > C(O, H, H).
Ponieważ C(Cl, H, H) > C(O, C, H) (bo Cl>O), stąd konfiguracja (S).
5. Wiązania podwójne i potrójne zamieniamy na dwa lub trzy pojedyncze, np.:
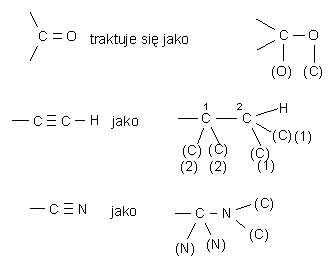
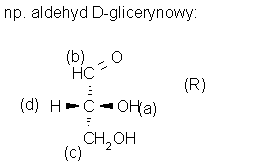
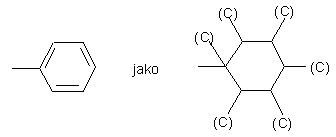
W związkach aromatycznych pierścień benzenowy traktujemy jako jedną z możliwych struktur Kekulégo, np.:
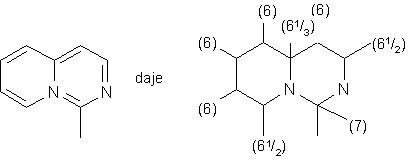
W związkach heterocyklicznych trzeba rozważyć wszystkie możliwe struktury rezonansowe i uśrednić liczby atomowe atomów powtórzonych we wszystkich wzorach, np.
6. Jeżeli centrum asymetrii jest atom trójwiązalny o trwałej konfiguracji piramidalnej,
to za czwarty atom przyjmuje się wolną parę elektronową o liczbie atomowej 0, np.
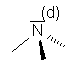
Dla określenia konfiguracji asymetrycznego atomu węgla stosuje się różne metody przedstawiania modelu cząsteczki na rysunku. Niemniej jednak, zawsze potrzebna jest pewna doza wyobraźni przestrzennej. Warto też korzystać z modeli kulkowych (nawet wykonanych z plasteliny i zapałek) lub utworzyć "trójwymiarowy" model cząsteczki za pomocą programu komputerowego, np. ACD ChemSketch. Przykład:
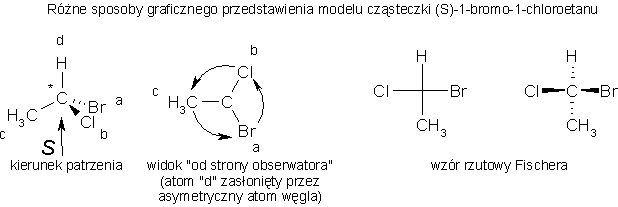
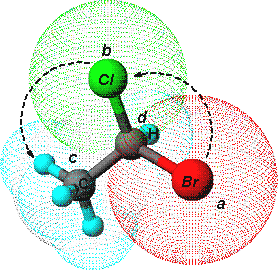
W powyższym przykładzie kolejność podstawników jest następująca:
Br > Cl > C(H,H,H) > H
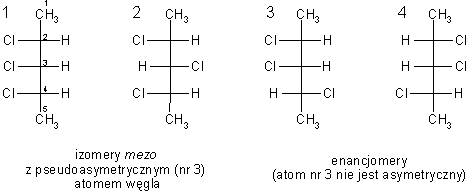
W cząsteczce może istnieć więcej niż jedno centrum asymetrii, centra te mogą mieć identyczną lub różną konstytucję oraz taką samą lub przeciwną konfigurację absolutną. Ogólnie, obecność w cząsteczce n asymetrycznych atomów węgla może dawać 2n izomerów. Izomery takie nazywa się enancjomerami, jeżeli ich cząsteczki stanowią odbicia lustrzane, a w pozostałych przypadkach - diastereoizomerami. Izomery, w których cząsteczkach występuje jednakowa liczba grup chiralnych o identycznej konstytucji a przeciwnej konfiguracji, nie wykazują aktywności optycznej i są nazywane izomerami typu mezo. W cząsteczkach takich występuje płaszczyzna symetrii. Szczególnym przypadkiem cząsteczki nieaktywnej optycznie jest cząsteczka z tzw. pseudoasymetrycznym atomem węgla. Jest to atom związany z czterema różnymi podstawnikami, z których dwa stanowią grupy asymetryczne o przeciwnej konfiguracji. W takim przypadku istnieją dwa nieaktywne optycznie diastereoizomery (oba są izomerami typu mezo), różniące się konfiguracją pseudoasymetrycznego atomu węgla, oznaczaną symbolami r, s. Przy ustalaniu pierwszeństwa przyjmuje się, że grupa w konfiguracji R ma pierwszeństwo przed grupą w konfiguracji S.
Dla przedstawienia struktury związku z wieloma asymetrycznymi atomami węgla, stosuje się konwencję rzutową Fischera. Asymetryczne atomy węgla umieszcza się w płaszczyźnie rysunku, w jednej linii pionowej. Podstawniki końcowe w tej linii znajdują się domyślnie za płaszczyzną rysunku, a wszystkie podstawniki po bokach łańcucha znajdują się przed płaszczyzną.
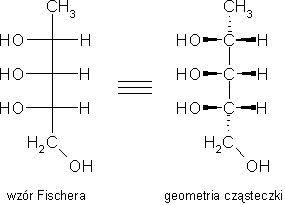
Opisane wyżej przypadki można zilustrować przykładami, zapisanymi w konwencji rzutowej Fischera.
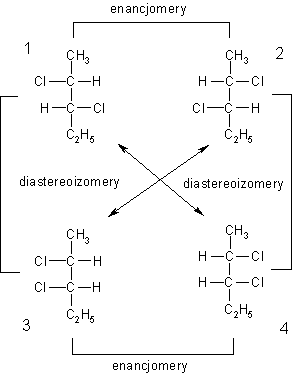
Przykład relacji enancjomery - diastereoizomery w przypadku izomerów 2,3-dichloropentenu
W nazwach izomerów określa się konfigurację obu asymetrycznych atomów węgla:
izomer 1: (2R,3R)-2,3-dichloropentan
izomer 2: (2S,3S)-2,3-dichloropentan
izomer 3: (2R,3S)-2,3-dichloropentan
izomer 4: (2S,3R)-2,3-dichloropentan
Przykład związku posiadającego izomer mezo
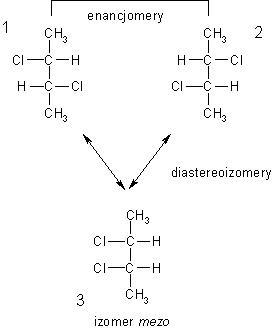
izomer 1: (2R,3R)-2,3-dichlorobutan
izomer 2: (2S,3S)-2,3-dichlorobutan
izomer 3: (R,S)-2,3-dichlorobutan
Opracował:
Marek Walnik
Głuchołazy, marzec 2004
Literatura:
1. Nomenklatura Związków Organicznych, Polskie Towarzystwo Chemiczne, Warszawa 1992 (Część E, Stereochemia).
2. P. Mastalerz, Chemia organiczna, Państwowe Wydawnictwo Naukowe, Warszawa 1986.
3. G. Hallas, Stereochemia związków organicznych, wyd. II, Państwowe Wydawnictwo Naukowe, 1971.
4. P. Chmielewski, A. Jezierski, Słownik encyklopedyczny. Chemia, Wydawnictwo Europa, Wrocław 1999.