Typowe reakcje jonowe w roztworach wodnych przebiegają w taki sposób, że dwa rodzaje jonów różnoimiennych łączą się, tworząc substancję bardzo słabo zdysocjowaną.
W reakcji zobojętniania, jony H+ (ściślej: H3O+) łączą się z jonami OH-, tworząc praktycznie niezdysocjowane cząsteczki wody:
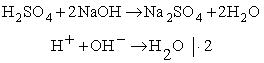
W reakcji wytrącania osadu, kationy metalu łączą się z anionami reszty kwasowej lub wodorotlenowymi, tworząc nierozpuszczalną w wodzie sól lub wodorotlenek, np.:
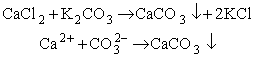
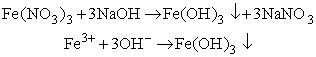
W reakcji wypierania elektrolitu słabego, jony H+ łączą się z anionami reszty słabego kwasu, który często jest przy tym słabo rozpuszczalny w wodzie, albo nietrwały, np.:
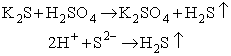
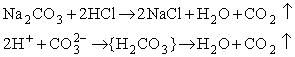
Analogicznie, wypierane mogą być słabe zasady (pomijając przypadki wytrącania nierozpuszczalnych wodorotlenków), np.
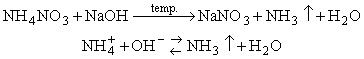
W reakcji hydrolizy soli, jony pochodzące od słabego kwasu lub od słabej zasady łączą się, odpowiednio, z jonami H+ lub OH- z wody, powodując zmianę odczynu na zasadowy lub kwaśny, np.

Wymienione wyżej typy reakcji jonowych w roztworach wodnych nie wyjaśniają jednak wszystkich, spotykanych na co dzień reakcji (pomijając reakcje utleniania-redukcji). Jaka reakcja zachodzi, na przykład, gdy do świeżo wytrąconego osadu Al(OH)3 dodamy roztworu NaOH? Osad wodorotlenku glinu rozpuszcza się, a reakcja jest typowym dowodem na jego amfoteryczny charakter. Otóż jest to równie typowy przykład reakcji kompleksowania - tworzenia związku kompleksowego:

Powstający jon glinianowy (dokładniej: tetrahydroksoglinianowy) jest w wodzie rozpuszczalny w obecności jonów Na+.
Już sama nazwa - "kompleksowy" sugeruje, że mamy do czynienia z czymś "złożonym". I rzeczywiście. Jon [Al(OH)4]- składa się z jednego jonu Al3+, z którym połączone są cztery jony OH-. Wiązania te nazywane są wiązaniami koordynacyjnymi i powstają dzięki parom elektronów walencyjnych, które w całości pochodzą od "dawców" (donorów) - jonów OH- i wykorzystują puste podpowłoki jonu glinu, który spełnia rolę "biorcy" (akceptora) tych par elektronowych. Jon glinu jest w tym kompleksie jonem centralnym, a jony OH- nazywane są tu
ligandami. Liczba tych ligandów, połączonych z jonem centralnym nosi nazwę liczby koordynacyjnej i jest odpowiednikiem wartościowości w "typowej" cząsteczce chemicznej. Liczba koordynacyjna jest zwykle charakterystyczna dla konkretnego jonu. Dla jonu glinu może wynosić 6, choć w naszym przykładzie przyjęliśmy dla uproszczenia 4 (tak jest w roztworach rozcieńczonych; w stężonym NaOH powstają jony kompleksowe
[Al(OH)6]3-). Wypadkowy ładunek elektryczny całego jonu kompleksowego jest sumą ładunków wszystkich składników tego jonu, czyli
"3+" + 4x"-" = "-"
Budowę jonu kompleksowego można więc przedstawić schematycznie:

Tworzenie jonów (i obojętnych cząsteczek) kompleksowych z różnymi ligandami jest charakterystyczne dla metali przejściowych, ale przykład glinu pokazuje, że zjawisko to spotkać można też u pierwiastków grup głównych układu okresowego.
Liczba koordynacyjna wynosi na przykład:
2 dla jonów Ag+
4 dla jonów Zn2+, Cu2+, Cu+, Hg2+ itp.
6 dla jonów Fe3+, Fe2+, Cr3+, itp.
8 dla jonów Mo4+, W4+
Kształt jonu kompleksowego zależy od liczby koordynacyjnej i innych czynników, np. jony z liczbą koordynacyjną 4 mogą być zarówno płaskie (ligandy znajdują się w wierzchołkach kwadratu, w którego środku znajduje się jon centralny) jak i tetraedryczne (czworościenne, podobnie jak cząsteczka metanu, CH4).
Związki kompleksowe tworzą się często przy zwykłym zmieszaniu roztworów zawierających odpowiednie składniki. Co więcej, właściwie wszystkie roztwory wodne soli metali zawierają jony tych metali w postaci mniej lub bardziej trwałych kompleksów z cząsteczkami wody. Klasyczny przykład to CuSO4: "czysty" siarczan(VI) miedzi(II) jest bezbarwny (na przykład otrzymany w reakcji stężonego, gorącego H2SO4 z miedzią). Po rozpuszczeniu w wodzie staje się on niebieski - bezbarwne jony Cu2+ łączą się bowiem z cząsteczkami wody w niebieskie jony tetraakwamiedzi(II), [Cu(H2O)4]2+. Zmieszanie niebieskiego roztworu CuSO4 ze stężonym kwasem solnym powoduje powstanie jonów [CuCl4]2- o barwie zielonej:
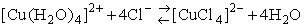
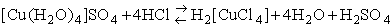
Reakcja jest odwracalna, a rozcieńczenie roztworu powoduje powrót barwy do niebieskiej. Warto zauważyć, że w reakcji tej jony miedziowe występują zarówno w anionie, jak i w kationie kompleksowym. Budowę jonu tetraakwamiedzi (II) przedstawia wzór:
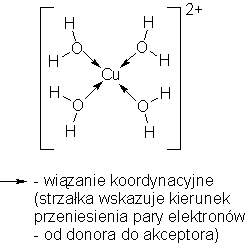
Uwodniony jon miedziowy tworzy intensywnie granatowo zabawione jony [Cu(NH3)4]2+ z roztworem amoniaku. Wodorotlenek miedzi(II) rozpuszcza się w stężonych roztworach zasad, tworząc jon [Cu(OH)4]2-, w którym ligandami są jony OH-. Podobne, choć bezbarwne kompleksy tworzą jony Zn2+. Jony Cr3+ tworzą barwne kompleksy, np. zielone [Cr(OH)6]3- z jonami OH-, czy wrzosowe [Cr(NH3)6]3+ z cząsteczkami NH3 (w stężonym roztworze NH3 z dodatkiem NH4Cl).
Przejawem reakcji kompleksowania jest, najczęściej, zmiana barwy roztworu lub rozpuszczenie się osadu w nadmiarze czynnika wytrącającego.
Reakcje kompleksowania przebiegają według schematu:
jon centralny + k ligandów = jon kompleksowy, gdzie k oznacza liczbę koordynacyjną
jonu centralnego, symbolicznie:
Mx+ + k Ly- = [MLk](x-ky), gdzie (x-ky) oznacza ładunek wypadkowy kompleksu. Na przykład:
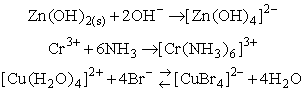
Odpowiednie reakcje w zapisie cząsteczkowym mogą mieć przebieg:
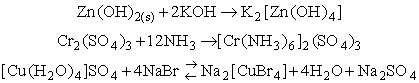
Rolę ligandów mogą pełnić różne cząsteczki i jony, posiadające pary elektronów niewiążących na powłoce walencyjnej, np. H2O, OH-, Cl-, CN-, NH3, liczne związki organiczne azotu i tlenu itp. Ligandy mogą posiadać kilka atomów z wolnymi parami elektronów i łączyć się kilkoma wiązaniami z jonem centralnym. Są to tzw. ligandy wielofunkcyjne (polidentatne), a kompleksy z nimi noszą nazwę kompleksów kleszczowych, czyli chelatowych (chelatów). Np.:
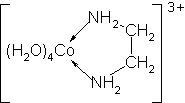 ,
,Jon centralny może być, jak widać wyżej, otoczony przez różne ligandy. Innym przykładem takiej sytuacji jest seria kompleksów chromu(III) z cząsteczkami wody i jonami chlorkowymi:
[Cr(H2O)6]Cl3, [Cr(H2O)5Cl]Cl2·H2O,
[Cr(H2O)4Cl2]Cl·2H2O - wszystkie o identycznym wzorze sumarycznym:
CrCl3·6H2O (tzw. izomeria jonowa).
Przykładem związków, w których oba jony są kompleksowe, jest para:
[Co(NH3)6][Cr(CN)6] i [Cr(NH3)6][Co(CN)6] (tzw. izomeria koordynacyjna).
Rysunek, który zdobi stronę tytułową działu "Chemia" w niniejszym serwisie, przedstawia model cząsteczki kompleksu obojętnego eletrycznie, tzw. pentakarbonylożelaza(0), Fe(CO)5 (atom centralny jest tu również obojętny):
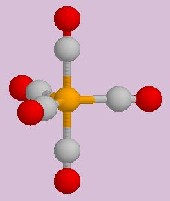
Para kompleksów cis- i trans- tetraaminadichlorokadmu(II), [CdCl2(NH3)4], jest z kolei przykładem występowania izomerii geometrycznej związków kompleksowych:
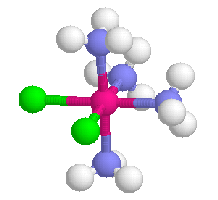
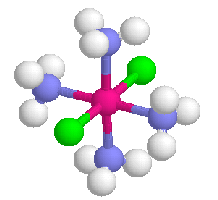
Znana jest również w przypadku kompleksów izomeria optyczna (kompleksy z dwoma lub trzema ligandami dwudentatnymi mogą występować w formach, które są wzajemnie odbiciami lustrzanymi) oraz izomeria wiązaniowa, gdy dany ligand może być połączony z jonem centralnym poprzez różne atomy (np.SCN-, który może tworzyć wiązanie przez atom siarki lub azotu).
Reakcje tworzenia kompleksów z jonów obecnych w roztworze są najczęściej reakcjami odwracalnymi i jako takie mogą być opisane ilościowo przez odpowiednie stałe równowagi, zwane stałymi trwałości kompleksu, np.:
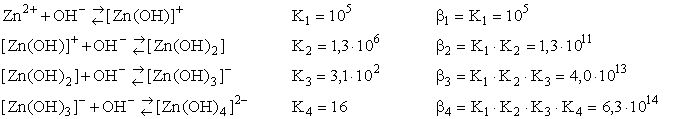 ,
,gdzie K1,2,..., to kolejne tzw. stopniowe stałe tworzenia, definiowane analogicznie, jak inne stałe równowag, np.
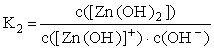 ,
,natomiast β1,2,..., to tzw. skumulowane stałe trwałości lub, po prostu, stałe trwałości, definiowane jako iloczyny kolejnych stałych stopniowych, np. β3=K1·K2·K3.
W chemii analitycznej reakcje kompleksowania odgrywają ważną rolę zarówno przy wykrywaniu kationów (analiza jakościowa) jak i przy pomiarze ich stężenia (analiza ilościowa). W tym ostatnim przypadku wykorzystuje się tworzenie barwnych kompleksów z odpowiednimi związkami organicznymi.
Związki kompleksowe znalazły zastosowanie w ogrodnictwie, jako składniki łatwoprzyswajalnych nawozów, np. dolistnych. W proszkach do prania stosuje się ligandy wiążące zawarte w wodzie jony żelaza i manganu, co zapobiega żółknięciu tkanin w czasie prania. W galwanotechnice kompleksy pozwalają otrzymywać powłoki z metali szlachetnych oraz ze stopów metali. W górnictwie złota używa się jonów cyjankowych do roztwarzania metalicznego złota z ubogich złóż. Dla zobrazowania takiego procesu proponuję proste doświadczenie z miedzią. Umieśćmy kawałki drutu lub blaszki miedzianej w naczyniach ze stężonym kwasem solnym oraz z amoniakiem. Pod wpływem tlenu z powietrza miedź utlenia się w ciągu kilku dni, przechodząc do roztworu w postaci odpowiedniego kompleksu - z jonami Cl- lub cząsteczkami NH3.
Związki kompleksowe pełnią olbrzymią rolę w przyrodzie ożywionej. Wystarczy wspomnieć o przykładach takich jak hemoglobina (kompleks żelaza(II)), witamina B12 (kompleks kobaltu), chlorofil (kompleks magnezu).
Dodatkowa lektura zalecana:
Z. Szmal, T. Lipiec, Chemia analityczna z elementami analizy instrumentalnej.
Podręcznik dla studentów farmacji, Państwowy Zakład Wydawnictw Lekarskich,
Warszawa 1988
F. A. Cotton, G. Wilkinson, P. Gaus, Chemia nieorganiczna. Podstawy, Wydawnictwo
Naukowe PWN, Warszawa 1995