Każdy początkujący chemik wie, że kawałek cynku (blaszka, granulki) wrzucony do kwasu solnego lub siarkowego reaguje dość energicznie, z wydzieleniem gazowego wodoru (bezbarwny gaz, zapalający się z charakterystycznym "szczeknięciem"):
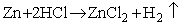
Zapiszmy tę reakcję jonowo, żeby ustalić, na czym polega jej przebieg:
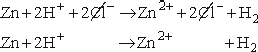
Zwróćmy uwagę, że reakcja ta składa się z dwóch procesów, zachodzących równocześnie (zasada zachowania ładunku!):
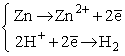
Obojętny elektrycznie atom cynku oddaje dwa elektrony walencyjne, stając się jonem dwudodatnim.
Przypomnijmy: atom cynku (Z = 30, A = 65) posiada jądro zawierające 30 protonów i 35 neutronów, wokół którego krąży 30 elektronów, obsadzających stany kwantowe zgodnie z konfiguracją: [Ar]3d104s2. Po oddaniu dwóch elektronów walencyjnych, opisanych orbitalem 4s, powstaje jon Zn2+, o konfiguracji [Ar]3d10, Ładunek tego jonu pochodzi stąd, że w jądrze jest nadal 30 protonów, ale wokół jądra znajduje się już tylko 28 elektronów rdzenia. Zatem wypadkowy ładunek elektryczny to +2 ładunki elementarne.
Proces oddawania elektronów w reakcji chemicznej jest nazywany zwykle utlenianiem.
W tym samym czasie dwa jednododatnie jony wodorowe łączą się z dwoma elektronami, tworząc obojętną elektrycznie cząsteczkę wodoru.
Proces przyjmowania elektronów w reakcji chemicznej jest nazywany redukcją.
Tak więc, prosta i powszechnie znana reakcja cynku z kwasem solnym okazuje się być reakcją utleniania-redukcji, co chemicy najczęściej określają żargonowym skrótowcem "redox". Zasada zachowania ładunku wymaga, aby utlenianie zachodziło równocześnie z redukcją oraz, aby liczby elektronów w obu procesach były równe.
Wracając do reakcji... Wiele osób zatrzymuje się na jej etapie i sądzi, że to "normalna" sytuacja, gdy metal reaguje z kwasem i powstaje sól i wodór. No bo, na przykład, żelazo też reaguje z kwasem solnym i siarkowym, magnez też... Ale:
- okazuje się, że miedź już z kwasem solnym, ani rozcieńczonym siarkowym nie reaguje (no chyba, że w otwartym naczyniu zostawi się ją w którymś z tych kwasów na jakiś tydzień),
- za to miedź reaguje z kwasem azotowym, ale tym razem nie wydziela się wodór, a jakiś brązowy gaz, o nieprzyjemnym zapachu, przypominającym trochę zapach chloru,
- co więcej, i cynk, i żelazo w reakcji z kwasem azotowym dają też ten niemiły gaz, zamiast wodoru,
- za to aluminium (jakież było moje zdumienie, gdy pierwszy raz przeprowadziłem tę reakcję) rozpuszcza się (fachowo - roztwarza) w roztworze zasady sodowej,
- natomiast sód reaguje (z wydzieleniem wodoru) z samą wodą,
- a złoto nie rozpuszcza się w żadnym kwasie, ale jak możemy przeczytać w książkach (nie stać mnie na samodzielne sprawdzenie ;)), rozpuszcza się w mieszaninie kwasów azotowego z solnym (tzw. woda królewska),
- do tego żelazo rozpuszczając się w kwasie solnym daje FeCl2, a nam jest akurat potrzebny FeCl3...
Ufff...
Sytuacja co najmniej skomplikowana, ale z jednym elementem wspólnym: we wszystkich reakcjach atomy metalu oddają elektrony, stając się jonami dodatnimi, a więc coś musi te elektrony przyjmować, redukować się. Obserwując naczynia, w których do kwasu solnego o jednakowym stężeniu wprowadzono po kawałku: magnezu, cynku, żelaza i miedzi, możemy zauważyć, że w tym szeregu reakcja zachodzi coraz spokojniej - od bardzo gwałtownej z magnezem, poprzez dość intensywną z cynkiem, spokojną z żelazem, do braku widocznej reakcji z miedzią. Nie radzę przy tym próbować reakcji kwasu solnego z sodem - jest to niebezpieczne, reakcja zachodzi tak gwałtownie, że zdarzyło mi się uszkodzić zlewkę szklaną, w której coś takiego próbowałem zrobić.
Jaka wielkość fizyczna, jaka właściwość atomów pierwiastka jest odpowiedzialna za to, że w szeregu Na Mg Zn Fe Cu zdolność do oddawania elektronów maleje? Dlaczego w przypadku żelaza powstają jony II, a nie III-wartościowe? Podobne pytania można postawić w odniesieniu do atomów niemetali i ich zdolności do przyłączania elektronów. Na przykład w reakcjach siarki z miedzią i żelazem powstają siarczki tych metali o wartościowościach (stopniach utlenienia) niższych, a w reakcji chloru z tymi metalami - chlorki tych metali o wartościowościach wyższych (odpowiednio: Cu2S i FeS oraz CuCl2 i FeCl3).
Pojęcie elektroujemności, które jest przydatne do opisu powstawania wiązań jonowych i spolaryzowanych okazuje się tutaj niewystarczające.
Rozważmy jeszcze raz procesy połówkowe:
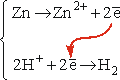
Pomiędzy układem zawierającym atomy i jony cynku a układem zawierającym cząsteczki i jony wodoru nastąpiło przeniesienie elektronów, a
więc przeniesienie ładunku elektrycznego. Z lekcji fizyki wiemy, że do przeniesienia ładunku elektrycznego konieczne jest wykonanie pracy, pracy
elektrycznej, której ogólny wzór ma postać, Wel = - QU, gdzie Q oznacza ładunek elektryczny, a U - różnicę potencjałów, która jest
odpowiedzialna za przeniesienie ładunku. Znak minus wskazuje w tym wypadku, że układ zmniejsza swoją energię. Pytanie, skąd pochodzi ta energia. Otóż każdy układ posiada określony zasób energii wewnętrznej, która w reakcji chemicznej może zostać zamieniona na ciepło, energię mechaniczną, świetlną lub elektryczną. Mówiąc w wielkim uproszczeniu - miarą tej części energii wewnętrznej układu, która może być zamieniona na pracę jest tzw. energia swobodna, a w pewnych przypadkach tzw. entalpia swobodna, oznaczana symbolem ΔG. Jeżeli więc podczas reakcji chemicznej
zachodzi zamiana energii chemicznej układu na pracę elektryczną, możemy zapisać: ΔG = - QU. W równaniu tym występuje różnica potencjałów. Wynika więc z tego, że układowi, który oddaje lub przyjmuje elektrony odpowiada jakiś potencjał elektryczny, mierzony w woltach. Potencjał ten nazywany jest potencjałem elektrochemicznym. W tablicach możemy znaleźć wartości tzw. potencjałów standardowych, dla reakcji połówkowych typu: 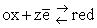 , gdzie ox oznacza formę utlenioną (np. Fe3+), red - formę zredukowaną (np. Fe2+), a z - liczbę elektronów w procesie (w przykładzie z żelazem, z = 1). Wartość standardowa oznacza, że wszystkie indywidua chemiczne, występujące w procesie są w ilościach standardowych, czyli - roztwory - w stężeniu 1mol/dm3, gazy pod ciśnieniem 1atmosfery,
ciała stałe lub ciecze - w stanie czystym, ponadto temperatura wynosi 298K. W jaki sposób wyznacza się te potencjały i w jaki sposób zależą one od stężeń, temperatury i ciśnienia, to historia na osobny artykuł. Rozważmy zatem przykłady, korzystając z gotowych danych, z tablic chemicznych.
, gdzie ox oznacza formę utlenioną (np. Fe3+), red - formę zredukowaną (np. Fe2+), a z - liczbę elektronów w procesie (w przykładzie z żelazem, z = 1). Wartość standardowa oznacza, że wszystkie indywidua chemiczne, występujące w procesie są w ilościach standardowych, czyli - roztwory - w stężeniu 1mol/dm3, gazy pod ciśnieniem 1atmosfery,
ciała stałe lub ciecze - w stanie czystym, ponadto temperatura wynosi 298K. W jaki sposób wyznacza się te potencjały i w jaki sposób zależą one od stężeń, temperatury i ciśnienia, to historia na osobny artykuł. Rozważmy zatem przykłady, korzystając z gotowych danych, z tablic chemicznych.
I tak, dla reakcji cynku z kwasem solnym znajdujemy:
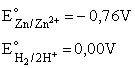
Widzimy więc, że wartości potencjałów standardowych określają biegunowość w układzie, a tym samym kierunek przeniesienia elektronów i kierunek reakcji utleniania-redukcji (elektrony, jako ładunki ujemne, przemieszczają się od bieguna ujemnego do dodatniego):
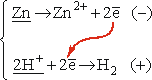
Podobne rozumowanie pozwala wyjaśnić, dlaczego jony H+ nie są wystarczające do utlenienia atomów miedzi do jonów Cu2+ (w tablicach wyszukujemy wartość potencjału dla układu Cu/Cu2+, oznaczoną np. (2+/0), w układzie okresowym wydawnictwa Adamantan):
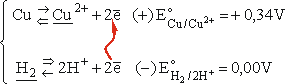
Tym razem to jony wodoru są w układzie o niższym potencjale i z kierunku możliwego przeniesienia ładunku wynika, że - przynajmniej teoretycznie - możliwa jest reakcja wypierania miedzi przez wodór z roztworu jej soli, a nie reakcja rozpuszczania miedzi w kwasach. Ogólnie - utleniacz musi pochodzić z układu o potencjale wyższym, a reduktor - z układu o potencjale niższym.
Miedź, jak wcześniej wspomniano, reaguje z kwasem azotowym, w którym rolę utleniacza spełnia jon azotanowy, a więc jon reszty kwasowej, przy czym potencjał standardowy reakcji redukcji tego jonu, np. do tlenku azotu (NO), wynosi aż +0,96V:
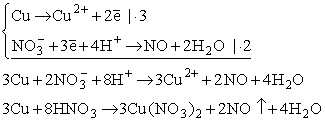
Kwasy, w których jedynym utleniaczem jest jon H+ nazywane są kwasami nieutleniającymi. Mogą one reagować wyłącznie z metalami o potencjale niższym od potencjału redukcji jonu H+, a więc mniejszym od 0V. Do takich kwasów zaliczamy HCl, rozcieńczony H2SO4, kwasy organiczne itp. Produktami reakcji takich kwasów z metalami są odpowiednie sole i wodór.
Kwasy utleniające posiadają resztę kwasową, która może ulegać redukcji. Należą do nich HNO3 oraz stężony H2SO4. Produktami reakcji takich kwasów z metalami są sole i produkty redukcji reszty kwasowej. Warto zauważyć, że reakcje takie mogą mieć złożony przebieg, zależny od stężenia i temperatury kwasu oraz potencjału elektrochemicznego metalu. Np. kwas azotowy, zależnie od warunków, może się redukować do N2O, NO, NO2, NH4NO3 i kilku innych związków. Niekiedy reakcja, teoretycznie możliwa, nie zachodzi. Mówi się wtedy o zjawisku pasywacji metalu. Zwykle wyjaśnia się to powstawaniem warstewki tlenku metalu na jego powierzchni, uniemożliwiającej dalszy przebieg reakcji. W rzeczywistości zjawisko to może mieć bardzo złożone przyczyny.
Metale, których potencjał elektrochemiczny jest większy od 0V nie reagują więc z kwasami nieutleniającymi, chyba, że w układzie znajduje
się dodatkowy utleniacz i/lub czynnik kompleksujący. Dlatego miedź rozpuszcza się powoli w kwasie solnym, w obecności tlenu z powietrza. Rozpuszcza się też w wodzie amoniakalnej, bowiem obecność cząsteczek amoniaku, tworzących kompleksy z jonami miedzi(I) i miedzi (II) znacząco obniża ich potencjały elektrochemiczne. Podobne zjawisko zachodzi podczas rozpuszczania złota w wodzie królewskiej, tj. mieszaninie stężonych kwasów azotowego i solnego. Z jednej strony w mieszaninie tej mogą powstawać indywidua chemiczne o wysokim potencjale elektrochemicznym, np. chlor, chlorek i podchloryn nitrozylu, ClNO i NOClO, z drugiej - nadmiar jonów chlorkowych powoduje kompleksowanie powstających jonów Au3+ i obniżenie ich potencjału elektrochemicznego. Dlatego złoto, którego potencjał elektrochemiczny (3+/0) wynosi +1,52V, roztwarza się w wodzie królewskiej, tworząc kwas tetrachlorozłotowy(III),
H[AuCl4].
Z drugiej strony szeregu elektrochemicznego znajdują się metale takie jak sód (E = -2,72V), czy potas (E = -2,93V). Tymczasem potencjał redukcji wody do wodoru i jonów OH- wynosi -0,83V i metale te energicznie reagują z wodą, np.:
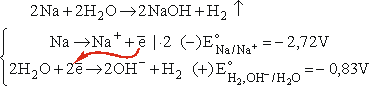
Ciekawym przypadkiem jest glin. Jego potencjał elektrochemiczny, wynoszący -1,70V, wskazuje na możliwość reakcji z wodą. Tymczasem, choć garnki lub czajniki aluminiowe są dziś coraz rzadziej spotykane, zaręczam, że można w nich wodę śmiało gotować, nawet godzinami, ryzykując (co mi się kiedyś udało), co najwyżej stopienie dna. Warstewka tlenku glinu jest dla czystej wody nie do pokonania. Ale wystarczy dodatek zasady sodowej, a glin energicznie reaguje z takim roztworem:
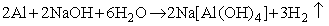
Podsumowanie przedstawionych rozważań zawiera schemat:
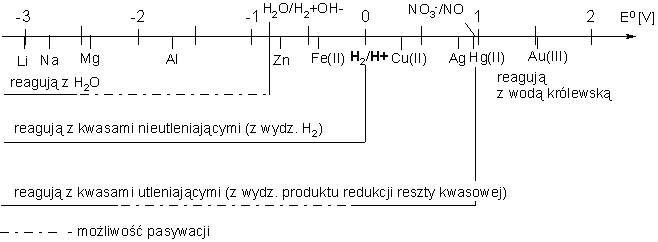
(Uwaga: przedstawione zagadnienia zostały przez autora uproszczone ze względów dydaktycznych. Ścisłe rozważania termodynamiczne wykraczają poza poziom nie tylko szkoły średniej, ale również wielu podręczników akademickich.)