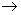 b
b 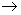 c i określamy kierunek - zgodny z ruchem wskazówek zegara (R, od rectus - prawy) lub przeciwny (S, od sinister - lewy). Np.
c i określamy kierunek - zgodny z ruchem wskazówek zegara (R, od rectus - prawy) lub przeciwny (S, od sinister - lewy). Np. REGUŁY CAHNA, INGOLDA, PRELOGA
pierwszeństwa podstawników
W nazewnictwie izomerów optycznych (system R - S) i w nazewnictwie izomerów geometrycznych (system Z - E) stosuje się tzw. reguły pierwszeństwa podstawników połączonych z atomem węgla - odpowiednio - asymetrycznym lub tworzącym wiązanie podwójne.
Choć na pierwszy rzut oka nazwy z symbolami "R,S" czy "Z,E" wydają się bardzo skomplikowane, okazuje się jednak, że - w typowych przypadkach - nie jest to nic specjalnie trudnego. Dla przypomnienia:
- asymetryczny atom węgla - to atom połączony z czterema różnymi atomami lub grupami atomów,
- izomeria geometryczna występuje (m. in.), gdy oba atomy węgla połączone podwójnym wiązaniem posiadają po dwa różne podstawniki.
1. Podstawniki szereguje się w kolejności malejących liczb atomowych (umownie a>b>c>d), np.
w CHFClBr: Br>Cl>F>H, gdzie znak ">" oznacza: "posiada pierwszeństwo w stosunku do" lub "poprzedza".
2. W celu przypisania symboli konfiguracyjnych każdemu z enancjomerów, obserwujemy ich modele od strony przeciwnej do podstawnika zaszeregowanego jako ostatni ("d"); następnie śledzimy drogę a 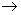 b
b 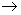 c i określamy kierunek - zgodny z ruchem wskazówek zegara (R, od rectus - prawy) lub przeciwny (S, od sinister - lewy). Np.
c i określamy kierunek - zgodny z ruchem wskazówek zegara (R, od rectus - prawy) lub przeciwny (S, od sinister - lewy). Np.
3. Jeżeli dwa podstawniki różnią się tylko masą atomową, to cięższy ma pierwszeństwo, np. D>H.
4. Jeżeli z centrum chiralności (sorry - z asymetrycznym atomem węgla) związane są dwa, trzy lub cztery identyczne atomy, to porównujemy dalsze atomy z nimi związane, np.:
a) H3C-CHCl-CH2OH
"rozpisujemy" atomy związane z danym atomem węgla:
-CH3 : C(H,H,H) i -CH2OH : C(O,H,H) (w nawiasach - kolejne atomy uporządkowane wg reguł pierwszeństwa). Ponieważ O>H, ostatecznie: Cl>CH2OH>CH3>H .
b)
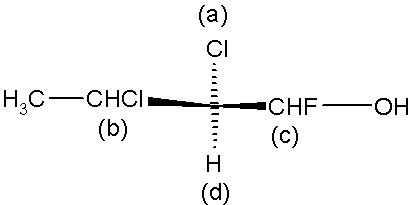
(S), bo: C(Cl, C, H) > C(F, O, H) (porównujemy preferowane atomy obu grup)
c)
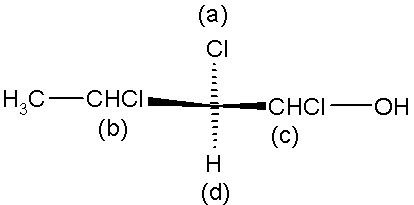
(R), bo C(Cl, O, H) > C(Cl, C, H)
d)
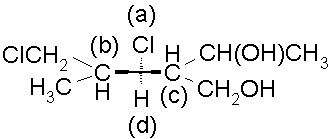
(b): C(C, C, H), gdzie C(Cl, H, H) > C(H, H, H);
(c): C(C, C, H), gdzie C(O, C, H) > C(O, H, H).
Ponieważ C(Cl, H, H) > C(O, C, H) (bo Cl>O), stąd konfiguracja (S).
5. Wiązania podwójne i potrójne zamieniamy na dwa lub trzy pojedyncze, np.:
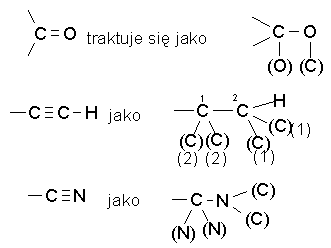
W związkach aromatycznych pierścień benzenowy traktujemy jako jedną z możliwych struktur Kekulégo:
np.
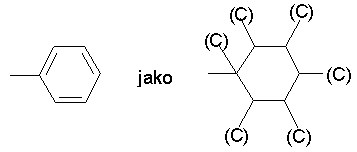
W związkach heterocyklicznych trzeba rozważyć wszystkie możliwe struktury rezonansowe i uśrednić liczby atomowe atomów powtórzonych we wszystkich wzorach, np.
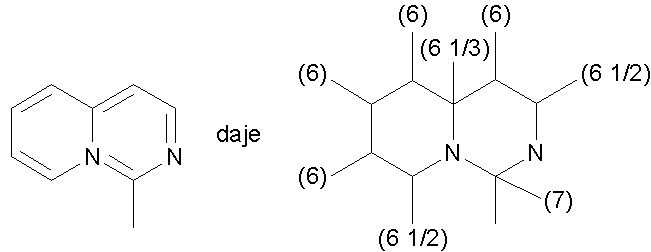
6. Jeżeli centrum asymetrii jest atom trójwiązalny o trwałej konfiguracji piramidalnej, to za czwarty atom przyjmuje się wolną parę elektronową o l. at. 0, np.
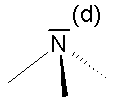
Jeżeli cząsteczka zawiera kilka asymetrycznych atomów węgla, dla każdego z nich ustala się konfigurację przestrzenną i zapisuje się przed nazwą związku, z podaniem odpowiednich lokantów (numerów atomów węgla), np.:
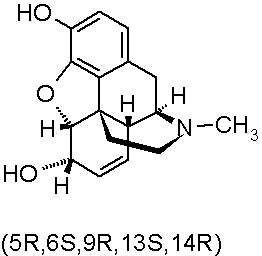
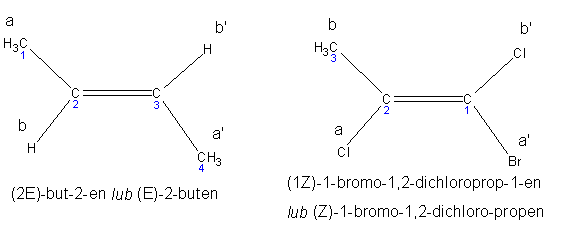
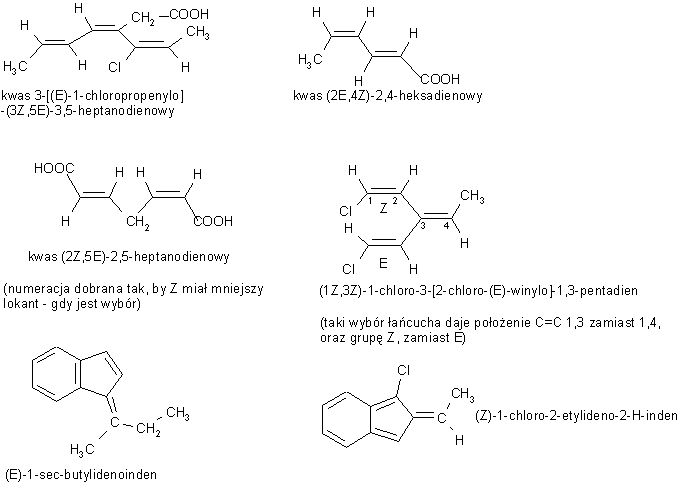
W przypadku cząsteczek, w których występuje izomeria geometryczna (tradycyjnie nazywana izomerią cis-trans), stosuje się oznaczenia "Z" i "E", od niemieckich słów "zusammen" - razem i "entgegen" - przeciwnie.
Warunkiem wystąpienia takiej izomerii, w typowym przypadku cząsteczki z wiązaniem podwójnym C=C, jest obecność dwóch różnych podstawników "po obu stronach" podwójnego wiązania. Ustalamy dla tych podstawników pierwszeństwo według podanych reguł, ustalając dla każdej pary kolejność a>b i a'>b'. Jeżeli podstawniki a i a' leżą "po tej samej stronie" osi wiązania, oznaczamy konfigurację jako "Z", w przeciwnym przypadku - "E". Oto kilka przykładów: