Układ okresowy pierwiastków jest prezentowany w wielu różnych formach - krótkiej, długiej, spiralnej, trójkątnej, cylindrycznej itd. itp...
Jedną z rzadko spotykanych form jest układ według Ackeroyda. Poniżej przedstawiono jego uproszczoną wersję, ograniczoną do pierwiastków grup głównych.
W układzie Ackeroyda centralną pozycję zajmuje grupa helowców. Niemetale znajdują się na lewo od niej, a metale na prawo. Dzięki takiemu układowi, na pierwszy rzut oka widać, jakie typy wiązań chemicznych tworzą atomy, poszczególnych pierwiastków.

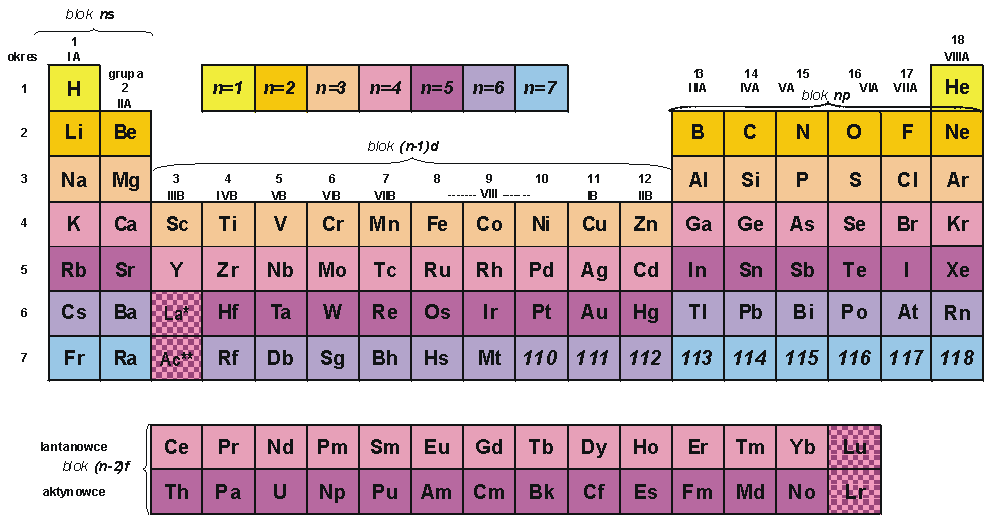
Kolejny rysunek przedstawia układ okresowy w formie długiej, z zaznaczonymi tzw. blokami pierwiastków. Taka forma pozwala na łatwe określenie budowy elektronowej atomów pierwiastków, w szczególności ustalenie, jaką podpowłokę elektronową zapełniają elektrony o najwyższej energii w danym atomie. Symbol n określa tu zarówno numer okresu, jak i wartość głównej liczby kwantowej powłoki elektronowej zapełnianej w danym bloku. Ściślej: w kolejnych blokach główna liczba kwantowa przyjmuje wartość: n, n, n-1 i n-2, gdzie n, to numer okresu. Warto dodać, że niektórzy autorzy proponują wręcz stosowanie wzorów konfiguracji elektronowej zamiast tradycyjnych numerów grup, np. grupa IA, czyli 1. wg IUPAC, to grupa ns1.
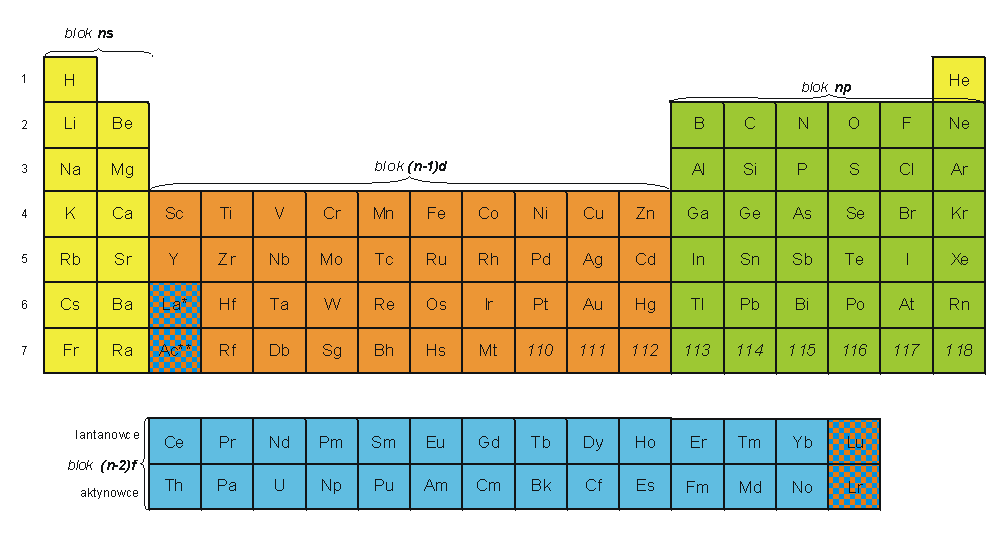
Inna tablica - ścisle związana z poprzednią - przedstawia kolejność zapełniania powłok elektronowych w atomach pierwiastków w poszczególnych okresach i blokach. Warto zauważyć, że pierwiastki lantan i lutet oraz aktyn i lorens należą zarówno do bloku (n-1)d, jak i do (n-2)f. Niektórzy autorzy podają, że lantan i aktyn powinny być pierwszymi pierwiastkami bloku f, odpowiednio w 6. i 7. okresie, a lutet i lorens powinny być zaliczane do grupy IIIB, a więc do bloku d. Symbol n określa tu wartość głównej liczby kwantowej powłoki elektronowej zapełnianej w danym bloku.