W 1786 r. włoski lekarz i przyrodnik, Luigi Galvani, zaobserwował zjawisko, które doprowadziło w następnych latach do wynalezienia urządzenia, które do dziś nosi nazwę ogniwa galwanicznego. Pierwsze ogniwo skonstruował inny włoski uczony, Alessandro Volta, w roku 1800.
W ogniwie galwanicznym energia chemiczna układu reagentów jest zamieniana na energię elektryczną. Reakcja utleniania-redukcji, która polega na przeniesieniu elektronów pomiędzy indywiduami chemicznymi, jest w ogniwie rozdzielona na dwie reakcje połówkowe - zachodzące równocześnie (zasada zachowania ładunku), ale w różnych miejscach układu. Elektrony przepływają przez zewnętrzny obwód elektryczny, a ich ładunek jest równoważony w układzie przez przepływ jonów ujemnych (anionów) w roztworze elektrolitu.
Najprostsze w budowie jest historyczne ogniwo Volty. Składa się ono z dwóch płytek, wykonanych z różnych metali, zanurzonych w roztworze elektrolitu. Rozważmy typowy przykład: w roztworze kwasu siarkowego (VI) zanurzone są płytki cynkowa i miedziana. Ponieważ z rozcieńczonym roztworem takiego kwasu reaguje tylko cynk, płytka z tego metalu pokrywa się szybko pęcherzykami wodoru, wypływającymi ku górze. Na płytce miedzianej nie obserwuje się żadnych przejawów reakcji chemicznej. Tak więc, w układzie zachodzi reakcja cynku z kwasem, według równania:
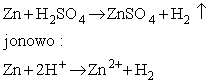
Zachowanie układu przedstawia schematyczny rysunek:
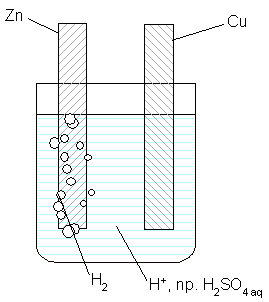
Elektrony są przekazywane bezpośrodnio przez atomy cynku do jonów wodorowych, które po zobojętnieniu do atomów, na powierzchni metalu łączą się w cząsteczki, a następnie w pęcherzyki gazu.
Sytuacja ulega radykalnej zmianie, gdy obie blaszki zostaną połączone przewodnikiem elektrycznym na zewnątrz układu:
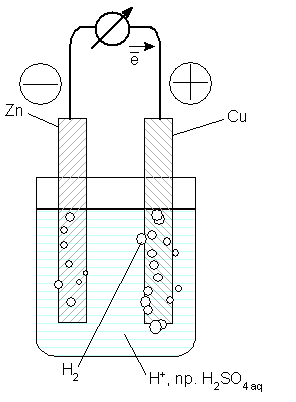
Otóż, różnica energii elektronów w obu blaszkach, stykających się z roztworem elektrolitu, powoduje, że elektrony przepływają od blaszki cynkowej do miedzianej, na powierzchni której zobojętniają jony wodorowe. Zatem reakcja zachodząca w roztworze nie ulega zmianie - przynajmniej w zapisie sumarycznym. Jednak procesy połówkowe - utlenianie atomów cynku (oddawanie elektronów) i redukcja jonów wodorowych (przyjmowanie elektronów) - zachodzą w różnych miejscach (czerwona strzałka obrazuje przeniesienie elektronów przez zewnętrzny obwód):
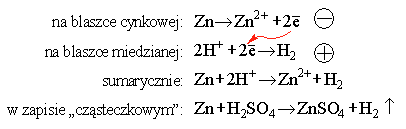
Dzięki różnicy potencjałów, powstającej pomiędzy płytkami zanurzonymi w roztworze, elektrony przepływają od blaszki cynkowej - elektrody ujemnej, do blaszki miedzianej - elektrody dodatniej. Zgodnie z nazewnictwem, wywodzącym się od XIX wiecznego uczonego brytyjskiego, Michaela Faradaya, elektrodę, na której zachodzi utlenianie (ujemną), nazywa się anodą, a elektrodę, na której zachodzi redukcja (dodatnią) - katodą*. Jest to więc oznaczenie biegunowości przeciwne, do spotykanego np. w elektronice, czy w procesach elektrolizy. Część układu, zawierającą płytkę metalową i jej najbliższe otoczenie nazywa się półogniwem lub, po prostu, elektrodą.
* - z greckiego: ana - "na(d)", "w górę"; kata - "pod", "w dół"; hodós - "ścieżka", "droga" (W. Kopaliński, Słownik wyrazów obcych i zwrotów obcojęzycznych, Wiedza Powszechna, Warszawa 1989)
Ogniwo Volty było używane jako praktyczne źródło prądu elektrycznego. Jego użycie umożliwiło dalsze odkrycia - m. in. wydzielenie drogą elektrolizy metali takich jak sód i potas. Obecnie różne odmiany takich ogniw, np. ogniwo Leclanchego, stosuje się na co dzień, jako tzw. baterie (choć tak naprawdę, bateria to układ wielu ogniw, połączonych zazwyczaj szeregowo). Są to tzw. ogniwa suche, w których roztwór elektrolitu ma postać żelu lub pasty, a całość zamknięta jest w szczelnej obudowie. Wydzielający się wodór jest pochłaniany przez tzw. depolaryzator, np. ditlenek manganu. Katodę wykonuje się często z grafitu, który wystarczająco dobrze przewodzi prąd elektryczny, nie reaguje przy tym z roztworem elektrolitu. Podobna jest też zasada działania i budowa różnego typu akumulatorów. Reakcje elektrodowe są w nich jednak odwracalne - po zużyciu substratów przepuszcza się przez ogniwo prąd elektryczny z zewnętrznego źródła, a zachodzące na elektrodach reakcje odtwarzają zużyte reagenty.
Ogniwa Volty są trudne w opisie teoretycznym. Obie elektrody mają kontakt z tym samym elektrolitem, produkty reakcji zmieniają skład elektrolitu i mają kontakt z obiema elektrodami. Trudno również obliczyć siłę elektromotoryczną, czyli napięcie pomiędzy elektrodami, mierzone w tzw. warunkach bezprądowych. Dlatego w elektrochemii konstruuje się inne typy ogniw, łatwiejsze w opisie teoretycznym, choć nie nadające się raczej na praktyczne źródła prądu. Są one stosowane jako wzorcowe źródła napięcia, służą też do pomiaru stężeń jonów, np. w miernikach pH.
Klasycznym przykładem jest ogniwo Daniella, skonstruowane w roku 1835. Obszary obu elektrod są oddzielone - znajdują się w odrębnych naczyniach lub w naczyniu przedzielonym na dwie części przegrodą półprzepuszczalną. W każdym naczyniu, w równowadze znajdują się tylko substrat i produkt jednej reakcji połówkowej. Na przykład, blaszka cynkowa zanurzona jest w roztworze jonów Zn2+, np. ZnSO4, a blaszka miedziana - w roztworze jonów Cu2+, np. CuSO4. Roztwory są połączone poprzez tzw. klucz elektrolityczny (choć bardziej współcześnie powinno się chyba mówić "zworka"). Jest to rurka szklana, w kształcie odwróconej litery "U" (jak mówią chemicy, "odwrócona U-rurka"), wypełniona nasyconym roztworem chlorku potasu lub azotanu amonu, zamknięta na końcach spiekiem szklanym (coś w rodzaju sztucznego pumeksu) lub, po prostu, ciasno zwiniętą bibułą. W "szybkich" pokazach, rolę klucza może spełniać nawet zwykły pasek bibuły, zwilżony odpowiednim roztworem. Klucz elektrolityczny łączy oba roztwory półogniw, umożliwiając dyfuzję jonów, a zapobiegając mieszaniu się tych roztworów. Dzięki temu obwód elektryczny, po połączeniu elektrod zewnętrznym przewodnikiem, jest zamknięty również wewnątrz ogniwa:
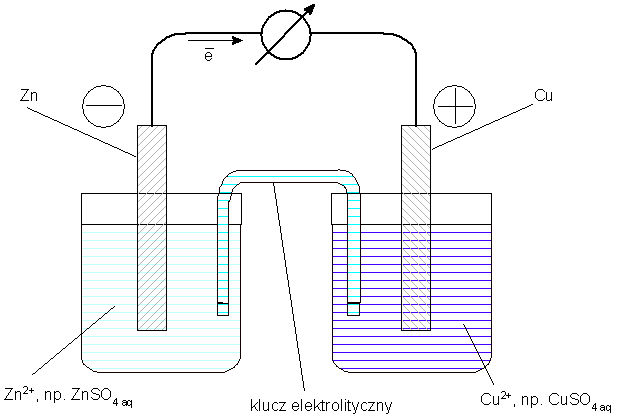
Schematycznie, budowę opisanego ogniwa zapisuje się następująco:


Po połączeniu elektrod zewnętrznym przewodnikiem, pojawia się pomiędzy nimi różnica potencjałów i zaczyna się przepływ elektronów. Blaszka cynkowa staje się biegunem ujemnym, blaszka miedziana - biegunem dodatnim. Elektrony, obdarzone ujemnym ładunkiem elektrycznym, przemieszczają się więc od bieguna ujemnego do dodatniego, decydując o zachodzeniu na elektrodach procesów połówkowych - odpowiednio - utleniania i redukcji:

W ogniwie zachodzi więc sumaryczna reakcja:
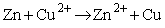
Jeżeli stężenia roztworów są równe 1 mol/dm3, a temperatura 298K, potencjały elektrod wynoszą, odpowiednio, -0,76V i +0,34V, zatem różnica potencjałów, czyli siła elektromotoryczna (SEM), wynosi: E = 0,34V - (-0,76V) = 1,10V.
Ponieważ nie można ustalić bezwględnej wartości potencjału jednego półogniwa - zawsze mierzy się różnicę potencjałów, należało arbitralnie ustalić jakieś półogniwo jako wzorzec wartości "zero" potencjału elektrochemicznego. Za taki wzorzec przyjęto standarową elektrodę wodorową. Jest to blaszka platynowa, pokryta rozdrobnioną platyną (czernią platynową), zanurzona w roztworze jonów wodorowych o stężeniu 1M, omywana strumieniem gazowego wodoru, o ciśnieniu 1atm. Blaszka platynowa umożliwia wymianę elektronów z układem reagentów wodór / jony wodorowe, a czerń platynowa umożliwia wydajny kontakt gazowego wodoru z powierzchnią platyny. Równowaga połówkowa tej elektrody:
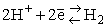
Aby więc wyznaczyć potencjał jakiejś elektrody, należy ją zestawić w ogniwo z elektrodą wodorową i zmierzyć różnicę potencjałów:
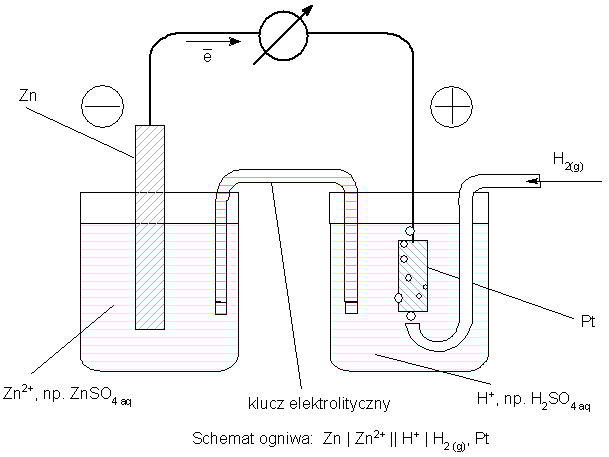
Warto zauważyć, że równania reakcji połówkowych i reakcji sumarycznej przedstawionego ogniwa są identyczne, jak we wcześniej opisanym ogniwie Volty.
Półogniwo typu M | Mn+ jest nazywane elektrodą metaliczną. Elektroda wodorowa należy do elektrod gazowych. Spośród innych typów półogniw, wymienić należy elektrodę oksydacyjno-redukcyjną. Jest to układ regentów zawierający formę utlenioną i formę zredukowaną danej substancji, z zanurzoną elektrodą platynową, np. układ zawierający jony żelazawe i żelazowe (Fe2+ i Fe3+):
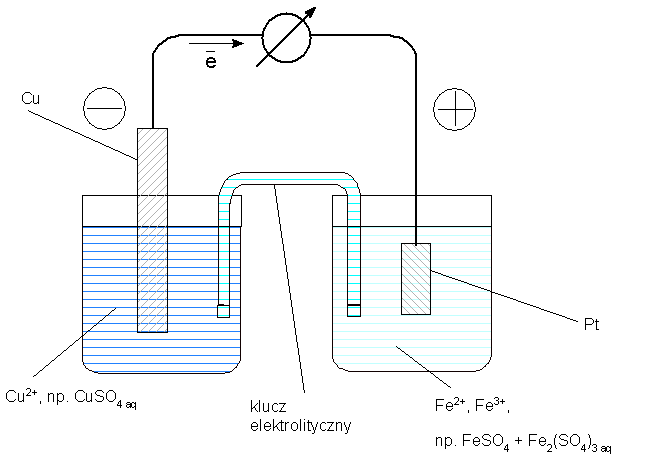
Reakcje połówkowe tego układu i reakcję sumaryczną można zapisać:
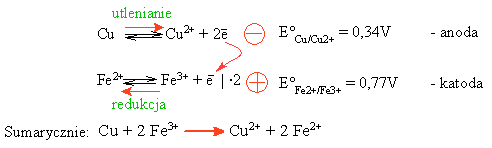
Potencjały elektrochemiczne, podawane w tablicach, są mierzone lub obliczane dla warunków standardowych. Wartość potencjału w innych warunkach określa wzór Nernsta:

Zależność potencjału elektrody od stężenia można wykorzystać dla pomiaru stężeń różnych jonów w roztworze, w szczególności - pomiaru pH. Można też skonstruować tzw. ogniwo stężeniowe, w którym obie elektrody zawierają te same reagenty, ale w różnych stężeniach. Reakcja sumaryczna w takim ogniwie prowadzi do wyrównania stężeń. Ogniwa galwaniczne mają wielkie znaczenie praktyczne. Wymienić należy wszelkie ogniwa ("bateryjki") zasilające wszelkiego rodzaju elektroniczne urządzenia przenośne, akumulatory i, stosowane coraz częściej, ogniwa paliwowe, w których na energię elektryczną przetwarzana jest energia chemiczna reakcji, takich jak spalanie metanu, czy alkoholu. Ale ogniwa to również pH-metry (mierniki pH roztworów), to różne laboratoryjne techniki pomiarowe (w tym wzorce potencjału). Wreszcie, ogniwa to korozja elektrochemiczna i ochrona przed korozją.
Opracował: MW 2006, na podstawie materiałów własnych
Literatura:
- Ryszard Sobiesiak, Poczet wielkich fizyków, Nasza Księgarnia, Warszawa 1969;
- Lucjan Sobczyk, Adolf Kisza, Chemia fizyczna dla przyrodników, Państwowe Wydawnictwo Naukowe, Warszawa 1975