na podstawie równania reakcji chemicznej
Mol został wprowadzony w XIX wieku do ilościowego opisu przebiegu reakcji chemicznych. Dlatego, oprócz opisanych we wcześniejszym artykule (Pojęcie mola) zastosowań pojęcia mola do obliczania ilości substancji, wyrażonej na różne sposoby, jest ono stosowane do obliczania ilości reagentów biorących udział w reakcjach. Współczynniki stechiometryczne w równaniu reakcji mogą być interpretowane jako liczby moli poszczególnych reagentów. Ilości reagentów w reakcji realizowanej w praktyce są zawsze wielokrotnością ilości wynikających z równania reakcji. Przykład:
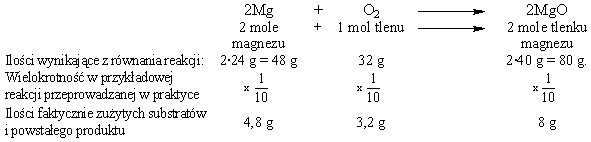
Oczywiście, ilości reagentów mogą być wyrażone w dowolny, "przeliczalny na mole" sposób - jako masy, liczby atomów lub cząsteczek, objętości w warunkach normalnych (dla reagentów gazowych). Zatem najprostsze zadania dotyczące ilości reagentów mają postać typu:
Zad. 1
Ile gramów kwasu solnego zużyło się w reakcji z cynkiem, jeżeli wydzieliło się 5,6 dm3 wodoru (warunki normalne)?
Zadanie to można rozwiązać na dwa sposoby. Prostszy, to proporcja, analogiczna do przedstawionej w przykładzie. Nieco mniej oczywisty, ale bardziej ogólny i pozwalający na rozwiązywanie również trudniejszych zadań jest sposób rozwiązania oparty w pierwszym etapie na samych liczbach moli reagentów.
Rozwiązanie:

Ile gramów siarczanu (VI) sodu powstanie w reakcji 10 g NaOH i 9,8 g H2SO4?
Zadanie zawiera pewną pułapkę. Dana jest ilość dwóch substratów reakcji, obliczyć mamy ilość jednego z produktów. Rzadko się zdarza, żeby podane ilości substratów były w proporcji stechiometrycznej, tzn., żeby oba substraty zużywały się w całości w podanej reakcji. Najczęściej jest tak, że jeden z substratów zużywa się w całości, a drugiego pozostaje po reakcji pewien nadmiar. Żeby ustalić, który z substratów zużywa się całkowicie, a tym samym wyznacza ilość powstającego produktu, należy pomocniczo założyć, że ilość drugiego substratu jest nieznana i ją na początku rozwiązania obliczyć.
Rozwiązanie:

Nieco bardziej złożone zadanie wymaga obliczenia ilości substancji, z której produkt powstaje w dwóch nstępujących po sobie reakjach (tzw. reakcjach następczych).
Zad. 3
Oblicz, jaką ilość siarki spalono, jeżeli do zobojętnienia powstałego tlenku siarki (IV) zużywa się 4 g NaOH (powstaje Na2SO3 i woda)?
Rozwiązanie
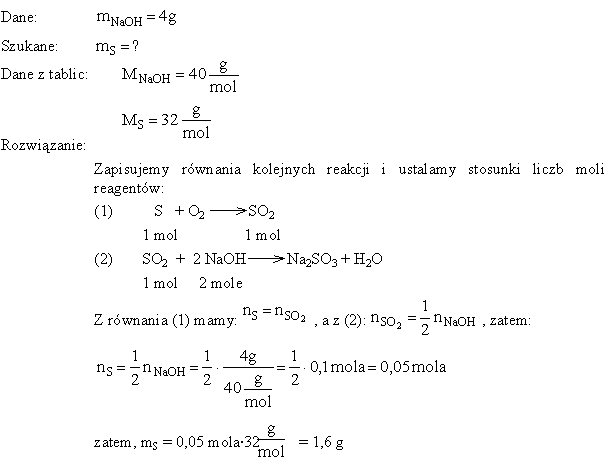
Zadanie powyższe można łatwo rozwiązać, obliczając proporcjami - najpierw, z drugiego równania reakcji, ilość powstałego SO2, później, z pierwszego równania reakcji - ilość zużytej siarki.
Do zadań najtrudniejszych (choć bez przesady) należą zadania, w których obliczyć należy ilości substratów w dwóch reakcjach zachodzących niezależnie (reakcjach spółbieżnych).
Zad. 4
8,5 g stopu sodu z potasem wprowadzono do wody, w sposób umożliwiający zbieranie wydzielającego się wodoru. Po przeliczeniu na warunki normalne, ilość wydzielonego wodoru wyniosła 3,36 dm3. Oblicz masy sodu i potasu w wyjściowej próbce stopu.


Znając ten wzór można rozwiązać typowe zadania, uwzględniające wydajność reakcji.
Opracował: MW 2005-2006, na podstawie materiałów własnych