Alkaloidy są związkami pierścieniowymi, często o dość skomplikowanej budowie, zawierającymi
w cząsteczkach, oprócz grupy aminowej, inne grupy funkcyjne - hydroksylową, karboksylową itd.
Ich prekursorami w roślinach są aminokwasy oraz puryny i pirymidyny.
Alkaloidy właściwe są to związki, których grupa aminowa pochodzi od cząsteczki aminokwasu, po jego dekarboksylacji. Pseudoalkaloidy to roślinne zasady azotowe, których grupa aminowa ma inne pochodzenie. Natomiast szkielet węglowy cząsteczek tych związków jest związany z biosyntezą terpenów, steroidów i in. Tzw. protoalkaloidy to związki powstałe z aminokwasów, o prostszej budowie - tzw. aminy biogenne.
Nazewnictwo alkaloidów, ze względu na ich skomplikowaną budowę, jest zwykle związane z nazwą rośliny, z której są otrzymywane lub z nazwiskiem badacza, który dany związek po raz pierwszy wyizolował.
Systematyka alkaloidów jest oparta na budowie szkieletu cząsteczki, w którym można wyróżnić określony układ heterocykliczny, np. pirolu, imidazolu, indolu itp.
Alkaloidy są zwykle substancjami krystalicznymi, rzadziej cieczami (np. nikotyna, koniina, sparteina). Są zwykle bezbarwne, źle rozpuszczają się w wodzie, natomiast łatwo rozpuszczalne są ich sole, choć zdarzają się wyjątki od tej reguły (np. kolchicyna, berberyna). Sole wielu alkaloidów są barwy żółtej do pomarańczowej. Ponieważ alkaloidy mają charakter zasadowy, a sok komórkowy roślin jest słabo kwaśny, alkaloidy w tkankach roślinnych występują często w postaci soli kwasów organicznych, charakterystycznych dla danego gatunku. Spotyka się również bardziej złożone połączenia - z garbnikami, cukrami, kwasami - odpowiednio garbniki alkaloidów, glikoalkaloidy, alkaloidy estrowe. Pamiętać należy, że większość alkaloidów to związki aktywne optycznie (najczęściej izomery lewoskrętne). Dlatego w ich wzorach strukturalnych stosowane są symbole wiązań skierowanych przed lub za płaszczyznę rysunku (patrz artykuł o izomerii optycznej). Ze względu na różnorodność budowy chemicznej i tworzonych przez alkaloidy naturalnych połączeń, ich ekstrakcja z materiału roślinnego i oznaczanie jest zwykle bardzo złożone i wymagające stosowania kombinacji wielu metod analitycznych.
W roślinach danego gatunku występuje zwykle wiele alkaloidów o podobnej budowie, należących
do jednej lub kilku grup. Są one syntezowane i gromadzone w różnych częściach rośłiny. Alkaloidy są syntezowane w istotnych ilościach (za taką przyjmuje się zawartość powyżej 0,01% w suchej masie
co najmniej jednego organu rośliny) u około 20% poznanych rośłin. Do roślin zawierających szczególnie dużo alkaloidów należą wszystkie gatunki z rodziny amarylkowatych.
Wszystkie alkaloidy amarylkowatych są silnie trujące (patrz, np. http://www.museums.org.za/bio/plants/poisonous/amaryllidaceae.htm), jednak stwierdzono, że mogą być surowcem do syntezy potencjalnych leków, m. in. antynowotworowych.
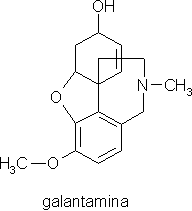
Z amarylkowatych wyizolowano ponad 100 alkaloidów. W 1947 r. Proskurnina i Arieszyna wyizolowały ze śnieżyczki, Galanthus woronowii, substancję nazwaną galantaminą. Występuje ona również w innych śnieżyczkach, pozyskuje się ją też z ungerni Wiktora, Ungernia victoris. Stwierdzono,
że galantamina obniża aktywność enzymu cholinesterazy, wpływając na stężenie acetylocholiny biorącej udział w przewodzeniu impulsów z komórek nerwowych do mięśni. Badano zastosowanie galantaminy
w leczeniu różnych chorób neurologicznych, ostatnio choroby Alzheimera.
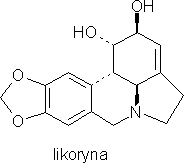
Inny alkaloid, likoryna, wyizolowana z Crinum longifolium, jest badana pod kątem zastosowania
w leczeniu nowotworów, choć w medycynie ludowej Chin, Japonii i Ameryki Centralnej stosowano preparaty z Crinum przy gorączce, bólach głowy, hemoroidach i różnych chorobach skóry.
Alkaloidy wyizolowane z bulw narcyza, Narcissus tazetta, badane są jako potencjalne leki w niektórych formach białaczki.
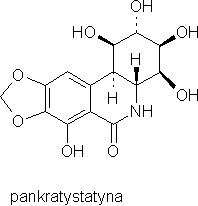
Z Pancratium littorale otrzymano pankratystatynę, również wykazującą właściwości przeciwnowotworowe.
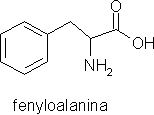
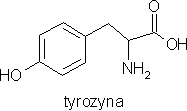
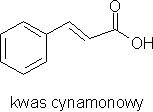
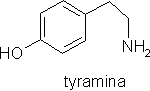
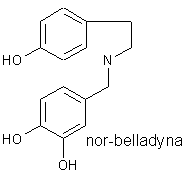
Prekursorem alkaloidów amarylkowatych jest nor-belladyna. Jej cząsteczka zawiera dwa pierścienie aromatyczne - jeden pochodny izochinoliny i dodatkowy - fenylowy. Pierwszy pierścień jest syntezowany
z tyrozyny, poprzez tyraminę (dekarboksylowana tyrozyna). Drugi powstaje z tyrozyny lub fenyloalaniny, poprzez, m. in., kwas cynamonowy. Metylacja nor-belladyny zachodzi z udziałem niespecyficznych enzymów, zdolnych do O-metylacji. Schemat biosyntezy tego związku podaje Kączkowski.
Pascal Vigneron, autor strony www.amaryllidaceae.org, klasyfikuje alkaloidy amarylkowatych następująco:
Grupa |
Seria |
Przykładowe związki |
Przykłady rodzajów lub gatunków roślin |
Uwagi |
| I | likoryny | likoryna, sternbergina, pluwina | Narcissus, Lycoris, Ammocharis tineana, Clivia nobilis | |
| narcyzyklasyny | likorycydyna, narcyklasyna, pankratystatyna | Hymenocallis littioralis | Ich
zadaniem jest prawdopodobnie hamowanie rozwoju roślin
konkurencyjnych. W farmacji badane jako ewentualne leki antynowotworowe i przeciwwirusowe. |
|
| homolikoryny | ||||
| masanany | kliwonina, kliwantyna, nobilizyna, nobilizytyna A i B | Clivia miniata, C. nobilis | ||
| II | krinany | ambellina, bufanidryna, bufanizyna, krinamidyna, krynina, fleksynina, powellina, undulatyna, hemantamina, bużenina | Crinum latifolium, Narcissus sp., Ammocharis tineana (zawiera 16 różnych związków z tej grupy) | |
| tacetyny | ||||
| III | buflawiny | |||
| augustaminy | ||||
| IV | montaniny | brunswigina, kokcyina, montanina, pankracyna | ||
| V | galantaminy | galantamina, narwedyna | Galanthus woronowi, Leucojum, Narcissus, Lycoris, Hippeastrum, Eucharis | Galantamina ma prawdopodobnie chronić roślinę przed owadami jako naturalny insektycyd. Stosowana w leczeniu chorób neurologicznych. |
Ważniejsze wzory chemiczne:
 |  |
 |  |
 |  |
 |  |
Literatura:
1. Ała Sadowska, Rośliny i roślinne substancje przeciwnowotworowe. Państwowe Wydawnictwo Naukowe, Warszawa 1991.
2. W. I. Artamonow, Riedkije i izcziezajuszczije rastienija, WO Agropromizdat, Moskwa 1989
3. Jerzy Kączkowski, Biochemia roślin. Tom I. Przemiany typowe, Państwowe Wydawnictwo Naukowe, Warszawa 1980
4. Jerzy Kączkowski, Biochemia roślin. Tom II. Metabolizm wtórny, Państwowe Wydawnictwo Naukowe, Warszawa 1985
5. H. Strzelecka i in., Chemiczne metody badań roślinnych surowców leczniczych. Podręcznik dla studentów farmacji, Państwowy Zakład Wydawnictw Lekarskich, Warszawa 1987
6. Jakub Mowszowicz, Przewodnik do oznaczania krajowych roślin trujących i szkodliwych, Państwowe Wydawnictwo Rolnicze i Leśne, Warszawa 1982
7. Jakub Mowszowicz, Rośliny trujące, Wydawnictwa Szkolne i Pedagogiczne, Warszawa 1990