Poznając reakcje, zachodzące w roztworach wodnych, stwierdzamy, że przemiany, w których biorą udział kwasy, zasady i sole mają mechanizm jonowy. Przypomnijmy najważniejsze typy takich reakcji: zobojętnianie, wytrącanie osadu, wypieranie słabego kwasu (zasady). Poniżej podano równania - w zapisie "cząsteczkowym" i jonowym - takich reakcji, po jednym przykładzie każdego typu.
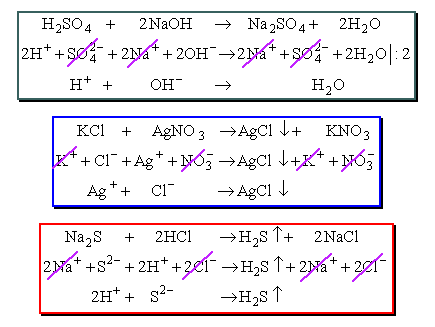 |
Zobojętnianie - jony wodorowe łączą się z jonami wodorotlenowymi w - praktycznie niezdysocjowane - cząsteczki wody. |
| Wytrącanie osadu - jony, pochodzące z nierozpuszczalnej w wodzie soli (kwasu, zasady), łączą się, tworząc osad. | |
| Wypieranie słabego elektrolitu (zwykle - kwasu) - jony, pochodzące od słabo zdysocjowanej substancji (kwasu, zasady), łączą się. Powstały związek jest często nierozpuszczalny w wodzie i opuszcza środowisko reakcji. W wielu przypadkach, powstający słaby kwas jest nietrwały i rozkłada się, np. na bezwodnik i wodę. |
Można zauważyć, że wszystkie te procesy mają podobny przebieg: jony łączą się w substancje słabo zdysocjowane, często również - słabo rozpuszczalne w wodzie. Jednakże, nie wszystkie reakcje z udziałem kwasów, zasad i soli da się opisać takim schematem. Oto przykład pierwszy:
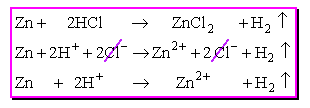
Pozornie, widać podobieństwo - tu też w reakcji biorą udział jakieś jony, inne pozostają niezmienione w roztworze. Jednak istota procesu jest zupełnie inna: atom cynku przekształca się w jon, a jony wodorowe zmieniają się w obojętną cząsteczkę.
Jeżeli pamiętamy, czym różni się jon od obojętnego atomu, zauważymy, że w układzie zaszły dwa równoległe procesy:
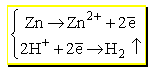
Zatem istota reakcji cynku z kwasem solnym polega na przekazaniu elektronów przez atomy cynku do jonów wodorowych. Tradycyjnie, takie procesy nazywane są, odpowiednio - oddawanie elektronów - utlenianiem, przyjmowanie elektronów - redukcją. Dlaczego tak? Jest tu analogia do "prawdziwej" reakcji utleniania - tworzenia tlenków metali, i reakcji ich redukcji. Oczywiście można to nazwać nowocześniej (za prof. Górskim) - dezelektronacją i elektronacją.
Całą reakcję nazywa się reakcją utleniania-redukcji (w żargonie chemików: reakcje redox), bowiem z zasady zachowania ładunku wynika, że utlenianiu musi towarzyszyć redukcja i na odwrót, ponadto liczba elektronów oddanych musi być równa liczbie elektronów przyjętych (tzw. bilans elektronowy).
Indywiduum chemiczne, które powoduje utlenienie innego indywiduum, nazywa się utleniaczem,
a to, które wywołuje redukcję innego - reduktorem. Utleniacz, w czasie reakcji, ulega redukcji, reduktor - utlenianiu. Tak więc, w powyższym przykładzie rolę utleniacza pełnią jony wodorowe, zaś reduktorami są atomy cynku (inaczej mówiąc - reduktorem jest metaliczny cynk).
Przykład drugi. Jony miedziowe chętnie biorą udział w reakcjach kompleksowania. Z jonami chlorkowymi i z jonami bromkowymi tworzą zielone kompleksy, odpowiednio, [CuCl4]2- i [CuBr4]2- (więcej o reakcjach kompleksowania na stronie: Reakcje kompleksowania). Zupełnie inny przebieg ma jednak reakcja jonów miedziowych z jonami jodkowymi. W układzie wydziela się osad (jasnobeżowy, jednak po odsączeniu i wypłukaniu okazuje się on biały), roztwór staje się brunatny, pojawia się charakterystyczny zapach. Po dodaniu niewielkiej ilości benzyny ekstrakcyjnej, jej warstwa zabarwia się na fioletowo. Zachodzącą reakcję opisuje następujące równanie:
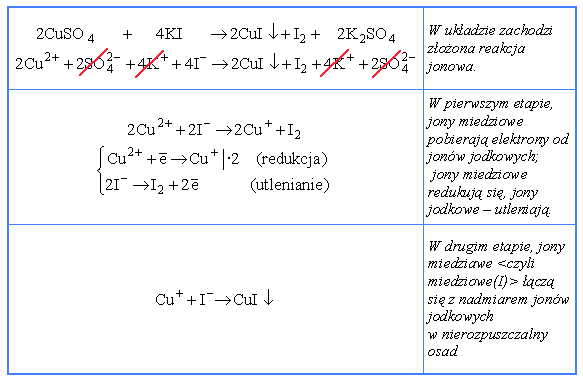
Innym przykładem jest reakcja roztwarzania miedzi w kwasie azotowym (V). Kwas azotowy należy do kwasów utlenianiających. Przebieg jego reakcji z metalami jest zwykle bardzo złożony i zależy od metalu, stężenia kwasu i temperatury (więcej na ten temat na stronie: Reakcje metali z kwasami..). W reakcji miedzi z rozcieńczonym kwasem azotowym powstaje azotan (V) miedzi (II), tlenek azotu i woda:


Czy można jakoś uprościć bilans elektronowy procesów, w których biorą udział cząsteczki i jony złożone? Jest to możliwe, jeżeli atomom wchodzącym w ich skład przypisze się "formalny" ładunek elektryczny, nazywany stopniem utlenienia. Liczbę elektronów w procesach połówkowych ustala się z prostego bilansu ładunku elektrycznego, pamiętając że ładunek elektronu wynosi -1.
Stopień utleniania definiuje się - nieco upraszczając - następująco:
- Stopień utleniania atomu pierwiastka w stanie wolnym wynosi 0.
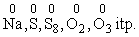
- Stopień utlenienia jonu prostego jest równy ładunkowi jonu.
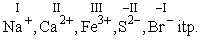
- Stopień utlenienia atomu w cząsteczce lub jonie złożonym jest równy wartościowości, ze znakiem wynikającym z polaryzacji wiązań. Obowiązuje przy tym reguła, że suma stopni utlenienia wszystkich atomów w cząsteczce jest równa zero, a w jonie złożonym - jest równa ładunkowi jonu.
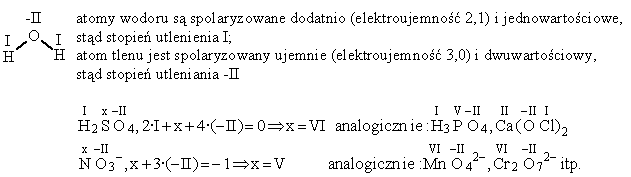
Obliczenie stopnia utlenianie atomu centralnego w kwasie, zasadzie lub soli opiera się na założeniu, że w typowych związkach atomy wodoru są na +I stopniu utlenienia, a atomy tlenu na -II. Oczywiście są też związki nietypowe. Np. w wodorkach metali atomy wodoru są na -I stopniu utleniania, w nadtlenkach atomy tlenu są na -I, a w cząsteczkach fluorku tlenu, atomy tlenu są na +II stopniu utlenienia.
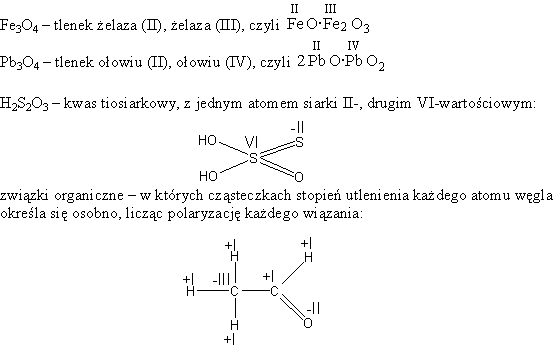
Inną grupę wyjątków stanowią związki, zawierające atomy na różnych stopniach utlenienia, np.
A teraz przykład zastosowania pojęcia stopnia utlenienia w typowym bilansie elektronowym reakcji utleniania-redukcji:

Oto kolejny przykład:
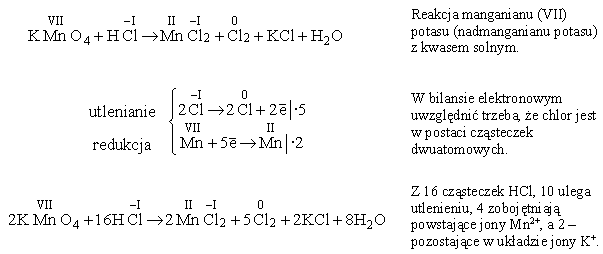
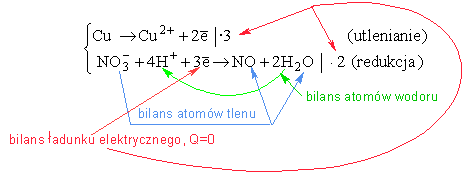
Analogicznie uzgadnia się bilans elektronowy dla reakcji utleniania-redukcji w zapisie jonowym. Jako dodatkowy sprawdzian poprawności można, po uzgodnieniu współczynników stechiometrycznych, porównać sumę ładunków elektrycznych obu stron równania reakcji:
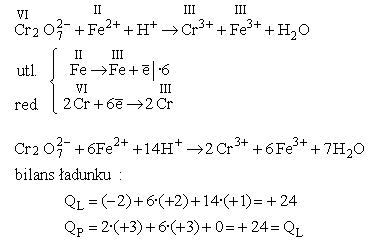
Specjalnym rodzajem reakcji utleniania-redukcji są procesy, w których rolę utleniacza i reduktora pełnią atomy jednego pierwiastka. W reakcji synproporcjonacji, substraty zawierają atomy danego pierwiastka na różnych stopniach utlenienia. W wyniku reakcji powstaje substancja, zawierająca atomy tego pierwiastka na pośrednim stopniu utlenienia. Jako przykład, rozważmy rekcję wodorku wapnia z wodą. W wodorkach metali wodór występuje w postaci jonów ujemnych, na -I stopniu utlenienia:
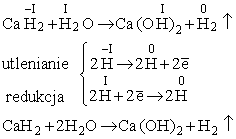
W reakcji dysproporcjonacji, atomy danego pierwiastka, będące na pośrednim stopniu utlenienia, przekazując sobie elektrony przechodzą na wyższy i niższy stopień utlenienia. Przykład - reakcja bromu z wodorotlenkiem potasu, prowadząca do powstania bromianu (V) i bromku potasu.
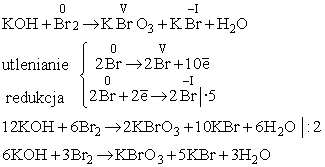
Kolejny, nietypowy przykład, to tzw. "autoredoks" lub utlenianie-redukcja wewnątrzcząsteczkowe. Przykład - inicjowany przez podwyższoną temperaturę rozkład dichromianu (VI) amonu:
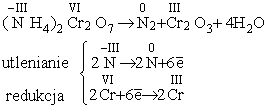
Na zakończenie, przykład nieco bardziej zaawansowany. W poniższej reakcji, substratami są disiarczek żelaza (II) (dwusiarczek żelazawy, występujący jako piryt, czyli tzw. "złoto głupców") i tlen. Atomy (a właściwie jony) żelaza w pirycie są na +II stopniu utlenienia, w reakcji powstaje tlenek żelaza (III). Utlenianiają się też atomy siarki, z -I stopnia utlenienia w jonie disiarczkowym, S22-, na +IV - w ditlenku siarki. W bilansie elektronowym uwzględnić trzeba zatem elektrony oddawane w obu tych procesach.
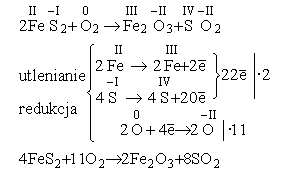
Zagadnienie, dlaczego jakaś substancja może utlenić / zredukować inną, związane jest z pojęciem potencjału elektrochemicznego, które omówiono na stronie Reakcje metali z kwasami.